Л.В. Шульгина,Е.В. Якуш,Ю.П. Шульгин,В.В. Шендерюк,Н.Н. Чукалова, Л.П. Бахолдина
Тихоокеанский научно-исследовательский рыбохозяйственный центр, Дальневосточный федеральный университет, Атлантический научно-исследовательский институт рыбного хозяйства и океанографии.
Проведен анализ ретроспективной информации о влиянии используемых в аквакультуре антибиотиков на состояние заболеваемости водных животных и человека.
Показано, что использование антибиотиков в аквакультуре для лечебных и профилактических целей представляет собой растущую проблему для мирового животноводства и здравоохранения. С продукцией аквакультуры в организм человека и в окружающую среду антибиотики поступают в концентрациях, вызывающих микробный дисбаланс, возникновение и распространение резистентных бактерий в обществе и природе. Устойчивость бактерий к различным антибиотикам снижает эффективность лечения инфекций у людей и животных, способствует росту заболеваемости, смертности и приводит к значительным экономическим потерям.
Введение
Активное промышленное разведение рыб и беспозвоночных, как правило, сопровождается распространением бактериальных инфекций (Alderman, 1996). Для снижения потерь при воспроизводстве водных объектов практически повсеместно проводятся профилактические или лечебные мероприятия с использованием антибиотиков, которые добавляют чаще всего в корм. При этом в пищевом сырье и продукции из объектов аквакультуры отмечается остаточное содержание антибиотиков, применяемых в терапии и профилактике бактериальных инфекций, поэтому присутствие значительных объемов импортной продукции аквакультуры на российском рынке приводит к поступлению в организм потребителя и окружающую среду различных антибиотиков, используемых в разных странах при товарном выращивании объектов. Отсутствие в нашей стране высокочувствительных методов идентификации антибиотиков, а также низкая эффективность существующего лабораторного контроля продукции аквакультуры не позволяют своевременно установить присутствие и остаточное содержание в ней многочисленных препаратов, применяемых в разных странах-производителях, оценить степень опасности их для населения и природы, что обусловливает особую медико-экологическую проблему, связанную с формированием множественной устойчивости к антибиотикам у патогенов и микроорганизмов внешней среды.
Цель настоящей работы — провести анализ ретроспективной информации по вопросу влияния антибиотиков, используемых в аквакультуре, на здоровье человека и окружающую среду.
Результаты и их обсуждение
Предпосылки к распространению возбудителей бактериальных инфекций и использованию антибиотиков в аквакультуре.
Интенсификация производства и увеличение объемов продукции аквакультуры приводят к ухудшению гидрохимического режима водоема за счет загрязнения водной среды продуктами метаболизма рыб и остатками корма, что способствует активизации роста численности сапрофитной, условно-патогенной и патогенной микрофлоры, нарушению процессов восстановления и самоочищения воды, эвтрофированию и увеличению индекса сапробности водоемов (Казимирченко, 2008; Маклакова и др., 2009; Обухова, 2013). Масштабный рост искусственного выращивания рыб чаще всего сопровождается деградацией водных экосистем, усилением дестабилизирующего воздействия на рыб различных стрессовых факторов естественного и антропогенного происхождения.
Водные объекты постоянно находятся в окружении микроорганизмов, которые способны проникать в них, ассоциироваться или находиться некоторое время в тканях и органах, не принося вреда. Они постоянно присутствуют в желудочно-кишечном тракте, откуда при определенных условиях могут быстро проникать во внутренние ткани и органы, активно размножаться. Постоянное присутствие в водной среде патогенной и
условно-патогенной микрофлоры представляет скрытый очаг бактериальных инфекций, который способен быстро реализоваться в виде вспышек массовых заболеваний среди как культивируемых объектов, так и аборигенных представителей природных водоемов.
Вспышки бактериальных заболеваний нередко приводят к смертности культивируемых рыб и беспозвоночных, трудно поддаются локализации при проведении лечебно-профилактических мероприятий, поэтому являются наиболее экономически значимым препятствием для развития аквакультуры (Гаевская, Ковалева, 1975; Ванятинский и др., 1979; Бауер и др., 1981; Огава и др., 1986; Håstein, 1988; Богданова, 1994).
В настоящее время на основе установленных критериев оценки значимости инфекционных болезней Международным эпизоотическим Бюро составлен список патогенов, в том числе для водных животных (http://www.oie.int). Их критерии включают потенциальные способности возбудителей к территориальному распространению, тяжесть влияния на восприимчивые популяции животных, вероятность возникновения внезапных, непредсказуемых чрезвычайных эпидемических и эпизоотических ситуаций. В список болезней включены заболевания (инфекционные, инвазионные, вирусные, грибковые и др.), представляющие реальный и потенциальный риски для хозяйств аквакультуры и рыбохозяйственных водоемов.
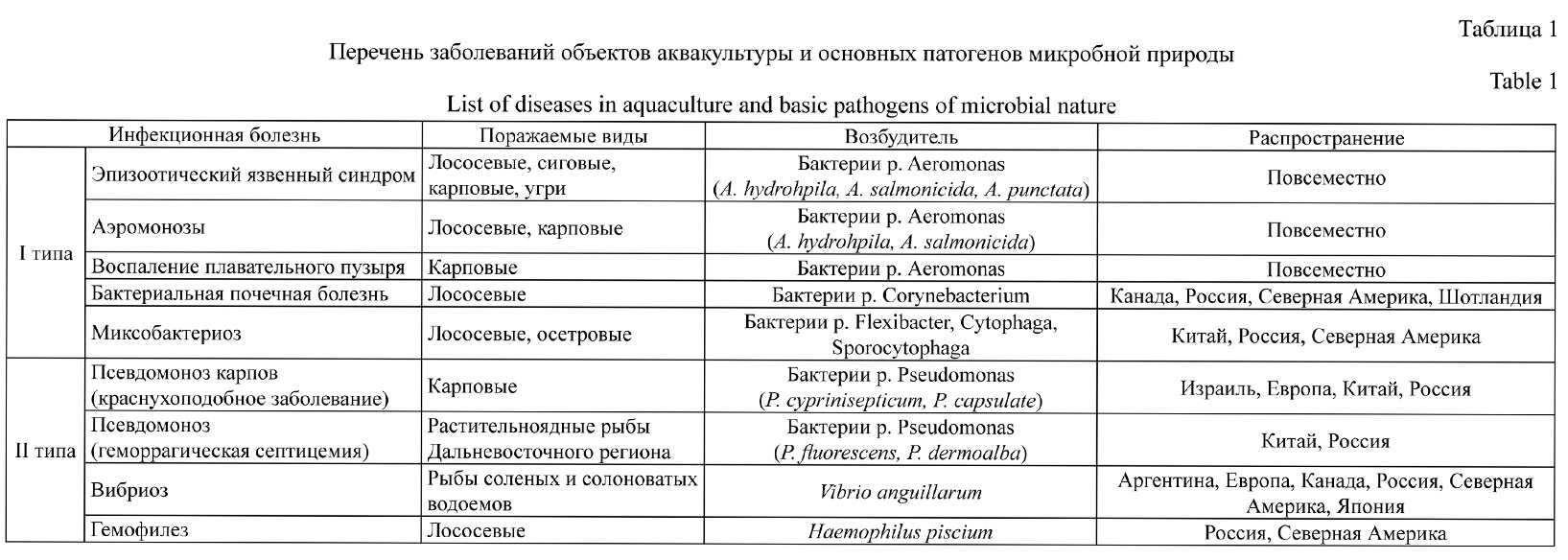
В табл. 1 приведены бактериальные инфекции, для лечения и профилактики которых, как правило, используются антибиотики. Болезни I типа включены в перечень
Международного эпизоотического Бюро, так как вызывают массовые заболевания
водных объектов и приводят к гибели значительного количества выращиваемых гидробионтов. Их возбудители распространены повсеместно (Макаров и др., 2012). Болезни
II типа имеют ограниченное распространение, чаще всего они возникают в отдельных
хозяйствах при нарушении технологии выращивания гидробионтов (Болезни рыб, 1989;
Садковая аквакультура …, 2010; Киуру и др., 2013). Их возбудителями являются условно-патогенные микроорганизмы, которые в нормальных условиях сожительствуют с
водным объектом.
Болезнетворное действие на организм животного возбудители инфекционных болезней оказывают своей патогенностью. Патогенность — это потенциальная способность
определенного вида микроба вызывать в организме соответствующий инфекционный
процесс. Под термином «инфекция» или «инфекционный процесс» подразумевается вся
совокупность явлений, происходящих в организме животного после проникновения в
него патогенных микробов. Для возникновения инфекционного процесса нужны наличие
возбудителя инфекции, обладающего определенной вирулентностью и восприимчивого к
данной инфекции животного (макроорганизма), а также определенные условия внешней
среды, необходимые для возникновения и развития инфекционного процесса. Вирулентность представляет степень или меру патогенности отдельных штаммов микроба, заключающуюся в способности размножаться в макроорганизме, подавлять его защитные
силы и оказывать болезнетворное действие на ткани и органы.
Инфекционный процесс не всегда сопровождается наличием признаков болезни
(Эндрюс и др., 2007). Например, при микробоносительстве или бессимптомном течении
инфекции клинические признаки болезни отсутствуют, хотя в организме животного
имеется возбудитель инфекции и взаимосвязь между ним и микроорганизмом обусловливает определенную иммунологическую перестройку. Инфекционный процесс, сопровождаемый проявлением признаков заболевания, называют инфекционной болезнью
или просто — инфекцией. Возбудители бактериальных болезней рыб по сравнению с
возбудителями инфекций теплокровных животных имеют некоторые особенности, так
как в процессе своего филогенетического развития они приспособились к биологическим
особенностям организма рыб как холоднокровных животных. Температура тела рыб
изменяется соответственно колебаниям температуры воды, в которой они находятся. В
связи с этим температурный оптимум, при котором возбудители инфекционных болезней
обладают способностью размножаться в теле рыбы и оказывать на нее патогенное дей-
ствие, колеблется в довольно широких пределах — от 10 до 25 оС и выше. Возбудители инфекционных болезней теплокровных животных и человека такой приспособляемостью к изменениям температуры почти не обладают. Вирулентность возбудителей уменьшается с понижением температуры воды, а вместе с этим и температуры тела рыб ниже указанного оптимума. Необходимо отметить, что факторы, обусловливающие вирулентностьмикробов (образование капсул, выделение агрессинов, образование экзотоксинов или эндотоксинов, диффузионный фактор), у возбудителей инфекционных болезней рыбпочти не изучены. У ихтиопатологов сушествует мнение, что возбудители инфекций ассоциируются вопределенных органах рыб и поражают их (Мишанин, 2012). Вместе с тем многие инфекции, напримеркраснуха карпов, фурункулез, чума щук и др., характеризуются общим поражением организма или группы органов и тканей в зависимости от формы заболевания. Возбудителиэтих болезней размножаются и обнаруживаются почти во всех органах. Патогенные микробы могут проникать в организм рыб и беспозвоночных через пищеварительный тракт, жаберный аппарат, кожу, слизистые оболочки, мочеполовую систему. Место проникновения патогенов в организм водного животного называется воротами инфекции, от его расположениязависит доля заболевших, форма (септицемия, бактериемия, пиемия,септикопиемия, токсемия) и прогноз болезни.
Инфекционные болезни у рыб могут проявляться в видепростой, смешанной и вторичной, или секундарной, инфекции (Мишанин, 2012). Простая инфекция вызывается одним возбудителем, асмешанная возникает при одновременном заболевании рыб двумя или несколькими болезнями. Например, у карпов в прудах иногда наблюдается одновременно развитиедвух заболеваний — бранхиомикоза (грибковое) и краснухи. Вторичная, или секундарная, инфекция у рыб возникает при наличии основной болезни и вызывается микробами, обычными обитателями кожи и слизистых оболочекпищеварительного тракта. Основная инфекция ослабляет организм,что способствует проявлению вирулентности возбудителями вторичной инфекции. Например, при заболевании прудовых рыб краснухой нередко развивается сильнейший дерматомикоз,
являющийся вторичной инфекцией.
На поверхности тел гидробионтов, в жабрах и кишечниках даже при благоприят-
ных условиях постоянно присутствуют условно-патогенные микроорганизмы, домини-
рующие в окружающей среде (Лаженцева и др., 2013). Например, представители родов
Aeromonas и Pseudomonas представляют собой один из компонентов бактериальной
флоры воды и обнаруживаются во всех водоемах, особенно загрязненных. Скрытое пре-
бывание возбудителя инфекции в организме водного животного при отсутствии внешних
признаков заболевания называется микробоносительством. При определенных условиях
эти бактерии могут вызвать тяжелейшие бактериальные инфекции — аэромонозы и
псевдомонозы, при которых гибель разводимых объектов может достигать 100 %.
Распространение массовых инфекций у объектов аквакультуры, причины, их вызывающие, равно как и методы борьбы с ними значительно отличаются от таковых у
человека и теплокровных животных (Богерук, 2007; Садковая аквакультура …, 2010;
Киуру и др., 2013). Прежде всего это связано с особенностями экологии и физиологии
рыб, а также своеобразием среды их обитания. Основной характеристикой здоровых
гидробионтов является способность приспосабливаться к изменяющимся условиям
среды. При нагрузках, превышающих приспособительные возможности, нарушают-
ся нормальные физиологические функции и возникает болезнь. Высокоинтенсивные
технологии выращивания гидробионтов, используемые в аквакультуре, предполагают
получение максимального количества продукции с единицы производственной площа-
ди. Высокие плотности посадки при выращивании гидробионтов (рыбы, моллюсков,
ракообразных и других объектов разведения) на морских фермах и пресноводных
рыбоводных предприятиях являются основной причиной для развития и распростра-
нения болезней. При уплотненной посадке рыб в прудах значительно снижается объ-
ем естественной ниши, приходящейся на каждую особь. Одновременно происходит
накопление экскрементов, слизи и других продуктов жизнедеятельности рыб и бес-
позвоночных и остатков концентрированных кормов (Канаев, 1974). В результате про-
исходит перенасыщение воды органическими веществами, вследствие чего снижается
содержание растворенного в воде кислорода и повышается количество углекислоты,
увеличивается выше допустимых пределов содержание нитратов и нитритов и других
вредных для разводимых объектов продуктов разложения органических веществ. Это
отрицательно сказывается на жизнедеятельности культивируемых объектов, вследствие
чего нарушается биологическое равновесие в экологической системе «паразит-хозяин»
и происходит ослабление общей резистентности их организма к воздействию неблаго-
приятных факторов внешней среды, а также к возбудителям инфекционных болезней.
Ослабление защитных механизмов у объектов аквакультуры способствует размножению
ассоциированных с ними условно-патогенных бактерий (возбудителей вторичных ин-
фекций), что приводит к возникновению новых патологических процессов у животных.
Болезни в аквакультуре возникают на каждом этапе биотехнического цикла, спектр
их меняется в зависимости от условий выращивания, видов водных животных, раз-
личных биотических и абиотических факторов окружающей среды, а также от ареала
распространения возбудителей болезней в пределах различных регионов.
Источником возбудителя инфекции вообще является тот организм водного живот-
ного, который служит местом естественного пребывания, размножения и накопления
возбудителя болезни и из которого он может попадать в другой организм или выделяться
во внешнюю среду. Применительно к рыбам источниками возбудителей инфекции могут
быть больные инфекционными болезнями рыбы и их выделения, рыбы — микробоно-
сители, трупы погибших от инфекций рыб, мясо инфицированных рыб. В естественных
водоемах — реках, морских лиманах, пойменных озерах — довольно часто наблюдается
заболевание сазанов краснухой. Больные сазаны являются естественным резервуаром
инфекции и при перевозке в культурные прудовые рыбоводные хозяйства заносят с
собой инфекцию. Из организма больных рыб возбудители инфекционных болезней
мoгyт выделяться через пищеварительный тракт (при краснухе, фурункулезе и пр.), через почки с мочой (при краснухе и фурункулезе), из ротовой и носовых полостей
(при сапролегниозе), через накожные язвы (при краснухе, фурункулезе), через жабры
(при бранхиомикозе), через половые органы с половыми продуктами (при краснухе,
фурункулезе, чуме щук и пр.). Трупы рыб, погибших в результате инфекционного за-
болевания, также являются источником возбудителя и инфицируют окружающую среду
патогенными микробами. Вопрос, как долго возбудители инфекции мoгyт сохраняться
в трупах погибших рыб, почти не изучен.
Механизм передачи инфекций или процесс перехода возбудителя из больного
организма в здоровый включает следующие звенья: выделение возбудителя инфекции
из зараженного организма; пребывание возбудителя во внешней среде; внедрение воз-
будителя в здоровый организм восприимчивого к инфекции животного. Локализация
возбудителя инфекции в определенных тканях и органах и механизм передачи этого
возбудителя от одного организма к другому находятся во взаимной связи и обусловли-
вают друг друга. Это обеспечивает сохранение возбудителя инфекции в природе как
вида и непрерывность эпизоотического процесса при любой заразной болезни рыб.
Распространение инфекций в аквакультуре осуществляется через различные эле-
менты внешней среды — вода, корм, почва ложа водоема, рыбоводный инвентарь, орудия
лова и т.д., через которые происходит передача инфекции от больных рыб здоровым
(Alderman, 1996; Альтов, 2002; Пестрикова, 2002; Богерук, 2007; Бурлаченко, 2007).
Возбудители болезней наиболее часто проникают из одних рыбоводных хозяйств в
другие при перевозках инфицированных рыб, или микробоносители попадают водными
путями из неблагополучных хозяйств в незараженные. Это происходит при отсутствии
гидросооружений, которые преграждают путь рыбам из одного водоема в другой. Ино-
гда из одних водоемов в другие переносят больных рыб рыбоядные птицы — цапли,
дикие утки, чайки и др.
В водоемах инфекционные болезни рыб распространяются при миграциях за-
раженного стада в верховьях рек для нереста или при прохождении молоди через
инфицированные участки рек. При залегании рыб на зимовку в ямах происходит
прямой контакт здоровых рыб с больными, в результате чего после зимовки инфекция
может быть занесена в другие водоемы. Механическим переносчиком инфекции из
одного водоема в другие, расположенные ниже по течению, может быть вода, являясь
хорошей средой для сохранения возбудителя, она способствует распространению
эпизоотических заболеваний среди рыб (Шестаковская и др., 2000). Течением воды
микроорганизмы могут переноситься в нижерасположенные пруды и представлять
скрытый очаг инфекции водных объектов, реализация которого возможна в любое
время. В распространении возбудителей инфекции немаловажную роль играет почва
дна водоема. На дне малопроточных или непроточных водоемов имеются иловые
отложения, в них присутствуют минеральные частицы и детрит со значительным
количеством органических веществ (50–80 %), разнообразие которых обеспечивает
благоприятные условия для развития микробов.
Немаловажную роль в распространении инфекции играют зараженные корма, ис-
пользование при скармливании непроваренного мяса больных рыб, зараженные инвен-
тарь и орудия лова (Альтов, 2002; Пестрикова, 2002; Богерук, 2007; Бурлаченко, 2007).
Нередко распространение болезней объектов аквакультуры между странами и
континентами связано с передвижением посадочного материала, торговлей рыбой и
живой икрой, которые являются источниками возбудителей таких инфекций, как по-
чечная болезнь, фурункулезы, вибриозы и др. (Hedrick, 1996; Yoshimizu, 1996).
Для снижения потерь в аквакультуре, обусловленных массовыми бактериальными
болезнями, практически во всех странах используются антибиотики (Alderman, Michel,
1992; Report of the regional donor consultation on the role of aquaculture and living aquatic resources:
priorities for support and networking : FAO Regional Office Asia and the Pacific. Bangkok
Thailand: RAP Publication, 2003. № 4. 90 p.)
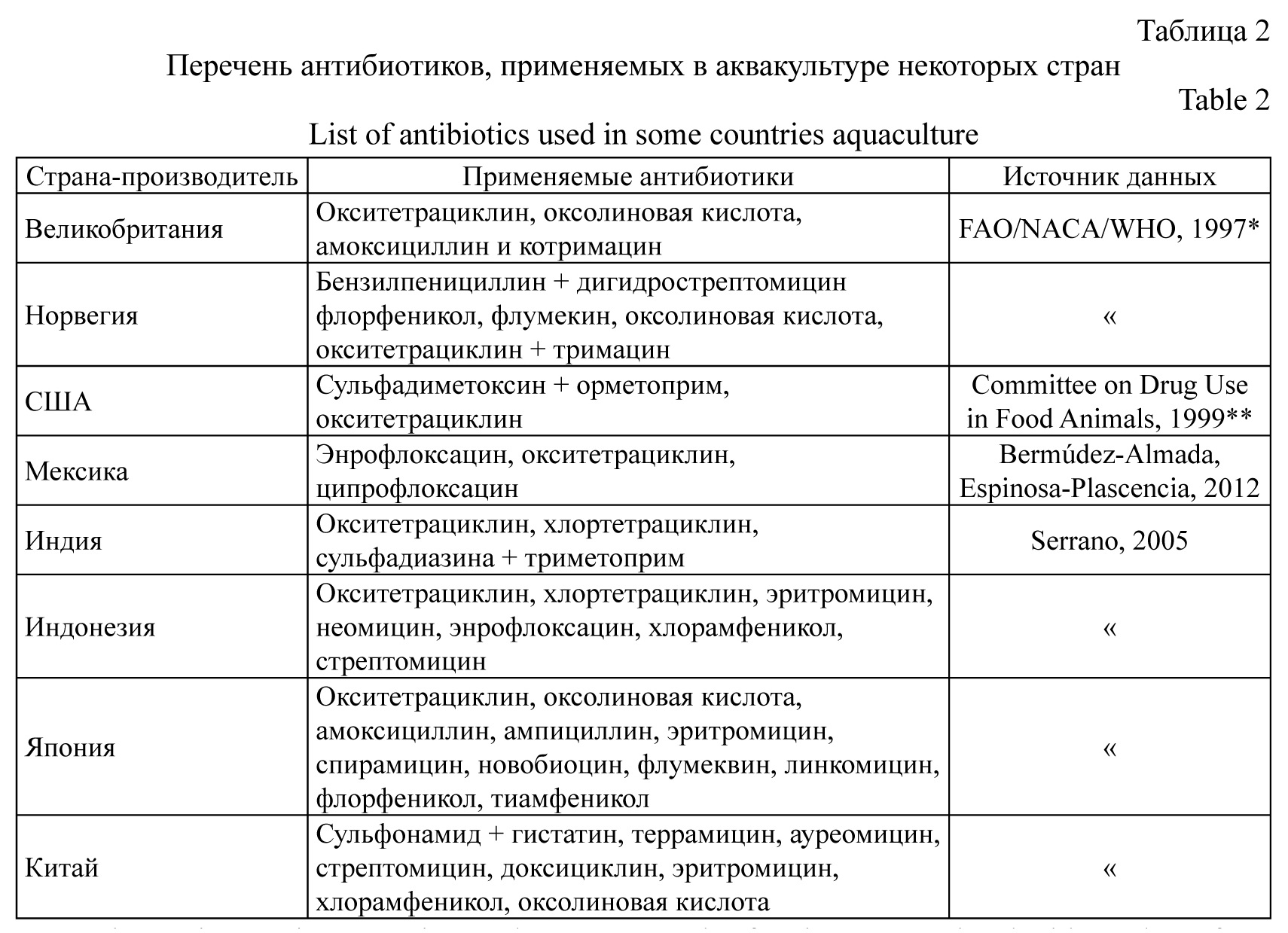 В табл. 2 приведен перечень антибиотиков, разрешенных и применяемых в аквакультуре некоторых стран, входящих в состав Международного эпизоотического Бюро.
В табл. 2 приведен перечень антибиотиков, разрешенных и применяемых в аквакультуре некоторых стран, входящих в состав Международного эпизоотического Бюро.
* FAO/NACA/WHO. Joint Study Group. Food safety issues associated with products from
aquaculture : WHO Technical Report Series. 1997. 883 p.
** Committee on Drug Use in Food Animals. The use of drugs in food animals: benefits and risks.
Based on reports commissioned by the Panel on Animal Health, Food Safety, and Public Health (a joint
activity of the [USA] National Research Council and the [USA] Institute of Medicine. Wallingford,
UK: CABI Publishing; Washington, DC: National Academy Press, 1999. 290 p.
Чувствительность и устойчивость возбудителей инфекций к антибиотикам
Антибиотики являются химическими соединениями как естественного, так и синтетического происхождения, вызывающими гибель или угнетение роста микро-
организмов. Появление антибиотиков в 1940-е гг. произвело революцию в медицине,
так как их применение позволило спасти жизни миллионов больных с тяжелыми
инфекциями, в том числе раневыми. Основное применение антибиотики получили в
медицинской практике, но в дальнейшем они активно стали использоваться в сельском
хозяйстве и аквакультуре, где приобрели огромную социально-экономическую важ-
ность. В связи с бурным развитием мировой фармакологической промышленности
арсенал антибиотиков постоянно пополняется множеством новых препаратов (На-
вашин, 1992; Информация …, 1998).
Действие антибиотиков на микроорганизмы проявляется в зависимости от наруше-
ний регуляции их физиологических механизмов, обусловливающих синтез клеточной
стенки, функцию цитоплазматической оболочки и внутриклеточные процессы синтеза
протеинов и нуклеиновых кислот, поэтому по механизму действия антибиотики подраз-
деляются на несколько групп (Федоров, 1974; Франклин, Сноу, 1984; Семёнов, Карцев,
2009). Первая группа объединяет вещества, ингибирующие синтез клеточной стенки
бактерий (муреина). К ним относят бета-лактамные антибиотики (пенициллины, цефа-
лоспорины, монобактамы и карбопенемы) и гликопептиды (ванкомицин, клиндамицин).
Во вторую группу входят антибиотики, вызывающие повреждение цитоплазматической
мембраны, а именно блокирование фосфолипидных или белковых компонентов, нару- шение проницаемости клеточных мембран, изменение мембранного потенциала и т.д.
К таким антибиотикам относятся полиеновые и полипептидные антибиотики. Однако
полиеновые антибиотики (нистатин, леворин, амфотерицин В, трихомицин, кандидицин
В) обладают ярко выраженной противогрибковой активностью, изменяя проницаемость
клеточной мембраны путем взаимодействия со стероидными компонентами, входящими
в ее состав именно у грибов, а не бактерий. Полипептидные антибиотики (полимиксин,
колистин, бацитрацин) обладают высоким сродством к плазматической мембране, по-
этому они одинаково токсичны как для бактерий, так и для эукариот, в связи с чем мало
применяются на практике, но благодаря своей способности избирательно транспорти-
ровать ионы через мембрану нашли применение в исследовательских целях в качестве
ионофоров. В состав третьей группы входят антибиотики, подавляющие синтез белка
в бактериальной клетке на всех уровнях, начиная с процесса считывания информации
с ДНК и кончая взаимодействием с рибосомами. Эта группа антибиотиков — самая
многочисленная, она включает аминогликозиды, макролиды, тетрациклины, хлорамфе-
никол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса
аминокислот на рибосомы. В четвертую группу включены антибиотики (например,
рифампицин), ингибирующие у бактерий синтез нуклеиновых кислот (ДНК-зависимую,
РНК-полимеразу). Эти антибиотики обладают не только антимикробной, но и цитоста-
тической активностью, поэтому применяются в противоопухолевой терапии.
По характеру действия антибиотики делятся на бактерицидные и бактериоста-
тические (Антибактериальная терапия, 2000; Семёнов, Карцев, 2009). Бактерицид-
ное действие характеризуется тем, что под влиянием антибиотика наступает гибель
микроорганизмов. Достижение бактерицидного эффекта особенно важно при лечении
инфекции, когда организм не в состоянии самостоятельно бороться с заболеванием.
При бактериостатическом действии гибель микроорганизмов не наступает, наблю-
дается лишь прекращение их роста и размножения. При устранении антибиотика из
окружающей среды микроорганизмы вновь могут развиваться. В большинстве случаев
при лечении инфекционных болезней бактериостатическое действие антибиотиков
в совокупности с защитными механизмами организма обеспечивает выздоровление
животного.
Гибель или стабилизация развития возбудителя инфекционного заболевания
возможны только при условии наличия его чувствительности к применяемому анти-
биотику. Чувствительность микроорганизмов к антибиотикам — это свойство микро-
организмов реагировать на действие препаратов приостановкой размножения или
гибелью. Каждый вид бактерий или близкая группа видов имеют характерный спектр
и уровень природной чувствительности по отношению к определенному или группе
антибиотиков. Мерой чувствительности бактерий является минимальная концентра-
ция антибиотика (мкг, ЕД), которая подавляет рост микробов на питательных средах в
стандартных условиях постановки опыта. В табл. 3 приведены антибиотики, к которым
проявляют чувствительность возбудители основных инфекций объектов аквакультуры
(Антибактериальная терапия, 2000; Определение чувствительности …, 2004*; Furones
et al., 2009).

По степени чувствительности к основным антибиотикам у бактерий выделяют
три категории чувствительности-устойчивости:
чувствительные (подавляются приназначении обычных доз антибиотиков), умеренно чувствительные (подавляются привведении максимальных доз препарата) и устойчивые (не подавляются при введении в организм человека даже максимально допустимых доз). Однако это деление условное, так как бактериальные клетки, подвергшиеся воздействию антимикробного вещества,стремятся защититься и противостоять его действию, проявляя классический пример
описанного Дарвином принципа естественного отбора — «выживает сильнейший».
В результате широкого использования антибиотиков бактерии эволюционировали и
приобретали устойчивость к их действию (antibiotic resistance), поэтому многие веще-
ства, ранее угнетавшие развитие определенных видов микробов, больше не оказывают
желаемого эффекта. Паспортизированный (установленный при разработке препарата)
спектр антимикробной эффективности каждого антибиотика со временем в процессе
его широкой эксплуатации существенно изменяется. Использование таких малоэффек-
тивных антибиотических препаратов в медицине, сельском хозяйстве и аквакультуре
привело к появлению в природе и среди патогенных микроорганизмов множественных
антибиотикоустойчивых видов, некоторые из них даже приобрели способность раз-
множаться в присутствии антибиотиков.
Для получения наиболее эффективного лечения и профилактики бактериальных
болезней в идеале необходимо установить фактическую чувствительность возбудителя.
Чаще всего это невозможно осуществить, так как в первую очередь необходимы пра-
вильная постановка диагноза болезни, выделение возбудителя в чистом виде и опре-
деление его чувствительности. Поэтому при производстве антибиотиков, как правило,
устанавливается чувствительность к ним различных видов бактерий и в инструкции
по их применению приводятся антибиотикограммы, с учетом которых необходимо
применять препараты в качестве лечебных или профилактических средств.
В течение длительного времени антибиотики являлись практически единственны-
ми средствами борьбы с заболеваниями рыб, поскольку позволяли быстро купировать
начинающуюся вспышку (Дорохов, 1955; Федоров, 1974; Кох и др., 1976). В дальней-
шем было отмечено, что введение в малых дозах антибиотиков в рацион животных с
профилактической целью позволило увеличить прирост их массы, иногда до 50 % по
сравнению с контрольными животными. Кроме стимуляции роста, они способствовали
повышению аппетита и лучшему (на 8–12 %) усвоению питательных веществ, что по-
зволяет сократить расходы корма до 20 %. Для повышения эффективности сельскохо-
зяйственных и водных животных стали практиковать введение в их корма антибиотиков
в относительно малых дозах на протяжении длительного периода времени (Иванов,
1957; Маликова, Котова, 1961; Кох и др., 1976; Бабенко, Оганесян, 1997; Грищенко и
др., 1999; Енгашев и др., 2005). Было установлено, что введение антибиотиков в корм
для рыб в небольших количествах, в сотни раз меньше их лечебных доз, стимулирует
рост и выживаемость рыб, компенсирует витаминную недостаточность, способствует
улучшению минерального и белкового обменов. Наиболее целесообразным оказалось
комплексное скармливание антибактериальных веществ, структурно далеких по химиз-
му и фармакологическому действию. Введение их в комбикорм позволило регулировать
микробиологические процессы в желудочно-кишечном тракте рыб, нормализовать микробное равновесие, предупреждать снижение количества антагонистов патогенных
бактерий и возникновение массовых заболеваний.
Исследование механизмов действия низких концентраций антибиотиков, стимули-
рующих рост и развитие животных, показало, что клетки макроорганизма, как и клетки
бактерий, чувствительны к действию антимикробных веществ (Федоров, 1974). Под
действием антибиотиков при высоких концентрациях происходит подавление роста и
разрушение клеток, как и у бактерий, а при низких дозах — его интенсификация. Было
установлено, что малые концентрации антибиотиков в рационах животных подавляют
рост микробов пищеварительного тракта, конкурирующих с организмом животного и
внесенных с пищей, в том числе патогенных видов. Следовательно, ростостимулиру-
ющее действие антибиотиков является результатом влияния на качественный и коли-
чественный состав их кишечной микрофлоры, а не прямого воздействия на обменные
процессы животного.
Вместе с тем многолетнее массовое применение антибиотиков в одном хозяйстве
приводит к снижению их ростостимулирующего эффекта. Это связано с тем, что в
водной среде и в пищеварительном тракте рыб отмечается накопление антибиотико-
устойчивых штаммов микроорганизмов. В настоящее время накоплено много сведений
зарубежных и отечественных исследователей о формировании резистентных штаммов
широкого круга патогенных бактерий, ассоциированных с объектами марикультуры, в
том числе у аэромонад, псевдомонад, флавобактерий, миксобактерий и других видов,
что приводит к снижению эффективности применения антибиотиков в аквакультуре
(Scott, 1981; Karunasagar et al., 1994; DePaola et al., 1995; Kruse et al., 1995; Юхименко
и др., 1998, 2003, 2005; Guardabassi et al., 2000; Furushita et al., 2003; Duran, Marshall,
2005; Lee et al., 2005; Orozova et al., 2010).
Известно, что некоторые микроорганизмы имеют природную антибиотикорези-
стентность, обусловленную отсутствием у микроорганизмов мишени действия анти-
биотика либо недоступностью мишени вследствие первично низкой проницаемости
или ферментативной инактивации (Страчунский, Козлов, 1994; Антибактериальная
терапия, 2000). Эта устойчивость является постоянным видовым признаком у бактерий.
Приобретенная устойчивость к антибиотикам представляет собой свойство от-
дельных штаммов бактерий сохранять жизнеспособность при тех концентрациях анти-
биотиков, которые подавляют основную часть микробной популяции (Страчунский,
Козлов, 1994; Навашин, Сазыкин, 1998; Антибактериальная терапия, 2000; Andersson,
2003; Livermore, 2003; Семёнов и др., 2004). Возникновение антибиотикорезистент-
ности нередко связано с изменениями в самой бактериальной хромосоме, возникаю-
щими в результате мутаций. При этом у бактерий возникает резистентность к одному
антибиотику, но передаваться хромосомная устойчивость может при всех видах гене-
тического обмена. В большой популяции бактерий, чувствительных к антибиотику,
содержится небольшое число генетически устойчивых к нему клеток. После гибели
чувствительных клеток под воздействием этого антибиотика закономерно происходит
появление новой популяции устойчивых клеток. Кроме того, нередко под действием
антибиотика или в его отсутствии происходят спонтанные мутации в популяции чув-
ствительных клеток, что также формирует анибиотикорезистентность (Greenwood,
1998). Появление устойчивости к антибиотикам у бактерий без участия хромосомы
часто связанo с наличием R-плазмиды, представляющей собой фактор множественной
лекарственной резистентности. Бактериальная R-плазмида несет сразу несколько генов,
ответственных за устойчивость к нескольким антибиотикам. Микробная клетка может
иметь несколько разных R-плазмид, что обусловливает возникновение полирезистент-
ных штаммов. Разнообразие генов устойчивости позволяет одному штамму бактерий
проявлять резистентность одновременно к нескольким антибиотикам (Delcour, 2009).
R-плазмиды могут передаваться от бактерии к бактерии с помощью конъюгации или
трансдукции, возможна и межвидовая передача внехромосомной устойчивости. При
появлении антибиотикорезистентных форм и взаимодействии их в биотопах с другой
микрофлорой происходит перенос гена устойчивости бактериям, не вступавшим в контакт с антибиотиками, как близкородственных видов, так и других семейств. Это
объясняет очень частое обнаружение бактерий с высокой антибиотикорезистентно-
стью из различных объектов внешней среды, а также в материале от больных водных
объектов и человека.
Характеристика рисков использования антибиотиков в аквакультуре
Применение лекарственных антибиотиков (используемых для человека) в аква-
культуре и в животноводстве порождает риски, степень которых очень высока. Риски
обусловлены как непосредственным отрицательным влиянием на человека или живот-
ных при попадании в организм с пищей или кормом, так и формированием антибио-
тикоустойчивых популяций возбудителей инфекций.
Ряд антибиотиков обладает непосредственным токсическим действием. Токсиче-
ское действие антибиотиков проявляется в виде поражения печени, почек, слухового
нерва и центральной нервной системы, нарушения синтеза витамина К и проявления
кровотечений. Под действием антибиотиков печень практически лишается способно-
сти накапливать гликоген. В уже поврежденную печень практически гарантированно
заселяются паразиты, а организм испытывает вялость, слабость, неуемный аппетит и
другие недомогания. Высокой генотоксичностью и канцерогенностью характеризуется
хлорамфеникол (левомицетин). Он обусловливает развитие апластической анемии
у людей, которая может быть вызвана даже низкими концентрациями антибиотика
(Sundlof, 1993). Известно, что апластическая анемия является необратимым заболева-
нием, летальность от которого достигает 70 %. В связи с этим хлорамфеникол запрещен
для использования при воспроизводстве различных видов животных.
В последние годы установлена иммунодепрессантная роль антибиотиков. Име-
ются сведения, что антибиотики в незначительных дозах отрицательно влияют на
клеточный и гуморальный иммунитет рыб, а также на другие звенья их иммунной
системы (Muiswinkel et al., 1981; Tafalla et al., 1999). Так, окситетрациклин на 40–75 %
уменьшает выработку сывороточных иммуноглобулинов и на 85–95 % — количество
бляшкообразующих клеток в почке и селезёнке, левомицетин подавляет антителооб-
разование, тетрациклин угнетает фагоцитоз.
Антибиотики, даже в незначительных количествах, могут вызывать сенсибили-
зацию организма человека и животных, приводя к развитию аллергических реакций,
которые проявляются в виде сыпи, зуда, крапивницы и других симптомов.
Употребление продуктов аквакультуры, содержащих остаточные количества
антибиотиков, приводит к накоплению этих соединений в организме, что ведет к
дисбактериозу и развитию антибиотикорезистентности (FAO/NACA/WHO, 1997;
Burridge et al., 2010; Cabello et al., 2013; и др.). При использовании антибиотиков,
особенно широкого спектра действия, наряду с возбудителями заболевания погибают
и некоторые представители нормальной микрофлоры, чувствительные к этим анти-
биотикам. При этом развиваются дисбактериозы, при которых освобождается место
для антибиотикорезистентных микроорганизмов, способных усиленно размножаться
и стать причиной вторичных эндогенных инфекций, как бактериальных, так и гриб-
ковых. Подавление антибиотиками нормальной микрофлоры приводит к нарушению
ее антагонистической активности по отношению к патогенным микроорганизмам, что
также может способствовать развитию различных заболеваний.
Широкое применение антибиотиков в аквакультуре привело к резкому сниже-
нию их эффективности (Dixon, 1994; Юхименко и др., 2003), нарушению экосистем
и микробиоценозов. Особое беспокойство вызывает тот факт, что сублетальные дозы
антибиотиков провоцируют появление не только слаборезистентных, но и высокоре-
зистентных штаммов бактерий. Так, большое количество антибиотикорезистентных
бактерий, выделенных из водных животных, которые обитали в относительно нетро-
нутой среде, объясняется попаданием в их организм очень малых доз антибиотиков
извне (Gullberg et al., 2011). Кроме того, воздействие пороговых доз антибиотиков при-
водит к изменениям других свойств бактерий, например повышению вирулентности,
что способствует восприимчивости рыб и беспозвоночных к возбудителям инфекций.
Нарушение экологического равновесия водоёма приводит к бурному развитию
дисбиотической микрофлоры, в которой преобладают энтеробактерии, появляются и
получают широкое распространение такие как P. fluorescens, Acinetobacter, капсуло-
образующие энтеробактерии, аэромонады, неферментирующие щёлочеобразователи и
другие ранее очень редко или не выделяющиеся возбудители. Изменение микробиоце-
ноза в водоёме существенно влияет на микробиоценоз рыбы, создаются благоприятные
условия для формирования так называемых ассоциативных заболеваний, например
бактериальной геморрагической септицемии рыб.
Применение антибиотиков в производстве пищевых продуктов животного про-
исхождения оказывает выраженное неблагоприятное действие на бактериальную
флору окружающей среды. При этом усиливается риск развития устойчивости к этим
препаратам и, как результат, к возникновению рисков в ветеринарии, аквакультуре и
медицине. Развитие устойчивости возбудителей многих инфекционных заболеваний
к антибиотикам существенно усложняет лечение населения. Наибольшую опасность
представляют полирезистентные возбудители, проявляющие устойчивость к несколь-
ким группам антибиотиков.
В настоящее время устойчивость к антибиотикам представляет серьезную и усу-
губляющуюся международную проблему общественного здравоохранения (Håstein,
1994; Борьба с устойчивостью …, 2011). Из-за устойчивости к антибиотикам возникли
инфекции, которые невозможно устранить. Это приводит к неудачам в лечении и уве-
личивает заболеваемость, смертность и экономические потери общества. Устойчивость
к различным классам антибиотиков стабильно возрастает у различных типов бактерий
в разных экологических системах.
Эпидемиология устойчивости к антибиотикам осложняется способностью генов
к горизонтальному распространению между различными типами бактерий с людьми,
водными и наземными животными, пищевыми продуктами и контаминированными
объектами внешней среды. В результате этого под угрозой находится значение анти-
биотиков как лекарств, спасающих жизни многих больных животных и человека. В
связи с этим Всемирная ассамблея здравоохранения в 1998 г. приняла резолюцию**,
в которой признала особую актуальность проблемы устойчивости к антибиотикам для
мирового здравоохранения и необходимость введения ограничения на использование
лекарственных для человека препаратов (антибиотиков) в животноводстве и аквакуль-
туре в качестве средств химиотерапии, профилактики и ростовых добавок. Однако
во многих странах-производителях продукции аквакультуры до настоящего времени
различные антибиотики продолжают использоваться для интенсификации товарного
выращивания объектов аквакультуры.
Заключение
Проведенный анализ данных показывает, что использование антибиотиков в
аквакультуре с позиций безопасности пищевых продуктов становится все большей
проблемой для мирового животноводства и здравоохранения. В современном товарном
выращивании объектов аквакультуры применяются антибиотики в терапевтических
целях, для профилактики заболеваний и в качестве стимуляторов роста. В связи с этим
большое количество здоровых водных животных систематически или часто получают
антибиотики. С продукцией аквакультуры в организм человека, а также в окружающую
среду с отходами производства антибиотики поступают в концентрациях, вызывающих
нарушения физиологических процессов в макроорганизмах, микробный дисбаланс,
возникновение, распространение и сохранение резистентных бактерий, которые
вызывают массовые инфекционные заболевания у животных и людей. Устойчивые
зоонозные бактерии могут передаваться людям как через пищевые продукты, так и
при непосредственных контактах или через объекты окружающей среды и вызывать
у них инфекционные болезни. Устойчивость бактерий к различным классам антибио-
тиков снижает эффективность лечения инфекций у людей и животных, способствует
росту заболеваемости, смертности и приводит к значительным экономическим поте-
рям. В связи с использованием во многих странах мира лекарственных антибиотиков
в аквакультуре и большими масштабами международной торговли ее продукцией
устойчивость бактерий в мире прогрессирует, что может привести к состоянию, при-
ближенному к доантибиотиковому периоду.
Источник: Известия ТИНРО 2015 Том 181 http://izvestiya.tinro-center.ru/jour/article/view/40



