Зайко Е.В.1, Панченко А.А.2, Cатабаева Д.М.1, Батаева Д.С.1, канд. техн. наук
1 ФНЦ пищевых систем им. В.М. Горбатова
2 Российский университет дружбы народов
Развитие устойчивости к антибиотикам, в том числе и множественной устойчивости, среди патогенных и условно-патогенных микроорганизмов рассматривается как глобальная проблема общественного здравоохранения. Продукты питания животного происхождения, особенно сырое мясо, является главным переносчиком устойчивых к антибиотикам патогенных бактерий.
По результатам собственных исследований установлено, что наибольшую устойчивость сальмонеллы, выделенные из мяса, проявляют к действию амоксициллина, эритромицина и тетрациклина, при этом к гентамицину устойчивость установлена не была. Бактерии L. monocytogenes в рамках этой работы проявили наибольшую устойчивость к антибиотикам тетрациклиновой группы и циплофлоксацину, но оказались чувствительны к действию амоксициллина, гентамицина и эритромицина. Результаты собственные и других исследователей являются доказательством чрезмерного использования антибиотиков в животноводстве. Данное обстоятельство будет способствовать передаче резистентных к антибиотикам «пищевых» патогенов через пищевую цепь человеку. Полученные результаты подчёркивают необходимость надёжных национальных программ по недопущению возникновения и распространения устойчивых к антибиотикам патогенных микроорганизмов через пищевые продукты, поскольку это может быть положительным вкладом в инициативу «единого здоровья».
Введение
Развитие устойчивости к антибиотикам, в том числе и множественной устойчивости, среди патогенных и условно-патогенных микроорганизмов рассматривается как глобальная проблема общественного здравоохранения.
Интенсификация животноводства с использованием противомикробных препаратов для лечения, профилактики
и стимулирования роста во многих странах привела к появлению лекарственной устойчивости среди комменсальной, условно-патогенной и патогенной микрофлоры [1, 2]. Бактерии «пищевого
происхождения», а также окружающейсреды и комменсальной флоры приобретают устойчивость благодаря горизонтальному переносу генов устойчивости.
Горизонтальному переносу генов часто способствуют мобильные генетические компоненты, такие как транспозоны, фаги и конъюгативные плазмиды [3, 4].
Резистентные к антибиотикам «пищевые» патогены поступают в организм человека через контаминированные продукты питания, воду и окружающуюсреду [5]. Продукты питания животного
происхождения, особенно сырое мясо, является главным переносчиком устойчивых к антибиотикам патогенных бактерий.
Поскольку наиболее эпидемиологически значимые «пищевые» патогены, такие как S. enterica, шига-продуцирующие токсин
E. coli, Capylobacter spp. при нарушении технологии и несоответствующей гигиены убоя часто приводят к перекрёстному
загрязнению [6]. Мясо также может быть контаминировано микроорганизмами в процессе транспортировки и хранения.
Следовательно, соблюдение строгих правил гигиены при убое, наряду с предупреждающими действиями в отношении
идентифицированных рисков, является необходимым условием для производства мяса высокого качества и безопасного для
потребителя [7, 8].
По сравнению с бактериями, вызывающими порчу, «пищевые» патогены представляют собой биологическую угрозу как возбудители желудочно-кишечных инфекций [9]. Через продукты питания
человеку могут передаваться такие микроорганизмы, как Escherichia coli (E. coli), Salmonella typhimurium (S. typhimurium), Staphylococcus aureus (S. aureus), Listeria monocytogenes (L. monocytogenes), Candida
albicans (C. albicans) и Cryptococcus neoformans (C. neoformans) [10]. При определённых условиях они являются источниками токсинов и микотоксинов и могут стать причиной геморрагической диареи,
энтерита, гемолитического уремического синдрома и др. заболеваний [11].
За последнее десятилетие в исследованиях как российских, так и зарубежных учёных было установлено появление «пищевых» патогенов с множественной лекарственной устойчивостью [12], которые могут снизить эффективность лечения, например,листериоза у людей. Кроме этого описана их устойчивость к химическим дезинфицирующим средствам [13], что затрудняет деконтаминацию производственных объектов от патогенных микроорганизмов.
Выявление и изучение генотипических и фенотипических признаков, циркулирующих в пищевой промышленности
штаммов бактерий, может стать научной базой при разработке надлежащих мер в борьбе с патогенами при выборе эффективных методов лечения инфекций.
Целью данного исследования является идентификация риска возникновенияустойчивых к антибиотикам «пищевых» патогенных микроорганизмов, выделенных из мяса убойных животных, в т.ч. птицы, и определение их профиля устойчивости.
Материалы и методы
В качестве объектов исследования при выявлении определённых микроорганизмов, а также антибиотиков были выбраны
свинина, говядина и мясо птицы.
Образцы были отобраны на мясоперерабатывающих предприятиях Центрального региона РФ в течении года. Для изучения профиля устойчивости к антибиотикам в качестве объектов исследования использовали микроорганизмы рода Salmonella и L. monocytogenes, выделенные из вышеперечисленных объектов.
Метод исследования мясного сырья на наличие антибиотиков
Мясное сырье было проанализировано качественным скрининговым методом на наличие антимикробных химиотерапевтических веществ. Для этого использовали тест-набор (Биотест–Пущино, Россия), в состав которого входили плотная питательная среда с индикатором бромкрезоловый пурпурный и суспензия спор Geobacillus stearothermophilus во флаконах по 10 см3,
а также пробочное сверло. Содержимое флакона растапливали на водяной бане, затем охлаждали в условиях комнатной температуры и сразу разливали в чашки Петри. С помощью пробочного сверла
в затвердевшей среде вырезали лунки.
Процедура подготовки аликвоты для исследования предусматривает деструкцию навески мяса массой 25,0 г в ножевом измельчителе с последующей гомогенизацией с 25,0 см3 физиологического раствора с помощью гомогенизатора (AES, Франция). Экстрагирование пробы проводили в термостате (Binder,Германия) при температуре (37 ± 1) ºC
в течение 90 мин, периодически перемешивая. Супернатант, полученный после центрифугирования экстрагированной
пробы при 3000 об/мин в течение 10 мин, вносили параллельно в две лунки тест-агара по 0,05 см3. Для эффективной диффузии в питательный агар чашки Петри с исследуемым материалом
выдерживали при (24 ± 1) ºC в течение 30 мин. Инкубировали чашки в термостате (Binder, Германия) при температуре(65 ± 1) °C не менее (3,5 ± 0,5) часов до изменения цвета среды с синего на жёлтый.
Ингибирование роста тест-культуры в зоне шириной ≥ 2,0 мм оценивали как положительный результат, т.е. как наличие антибиотиков или других антимикробных химиотерапевтических веществ в анализируемой пробе.
Наличие роста тест-культуры с изменением цвета питательной среды с синего на жёлтый или отсутствие роста тест-культуры в зоне шириной менее 2,0 мм оценивали как отрицательный результат, т.е.
как отсутствие антибиотиков или других антимикробных химиотерапевтических веществ в анализируемой пробе. Иден-
тификация антимикробных химиотерапевтических веществ другими методами в рамках данной работы не проводилась
Выделение и подтверждение L. monocytogenes
Все образцы мяса были исследованы на наличие бактерий L. monocytogenes в соответствии с ГОСТ 32031. 25 г навески мяса гомогенизировали в 225 см3 полуконцентрированного бульона Фрейзера (Merck, Германия) и инкубировали при температуре 30 °С в течение 24 ч. Затем 0,1 см3 обогащенной культуры добавляли к 10 см3 бульона Фрейзера (Merck, Германия) и культивировали при температуре 37 °С в течение 48 час. Из каждого бульона после окончания инкубации петлей, диаметром 3 мм, обогащенный материал наносили штрихом на хромогенный агар для листерий Агар Listeria по Оттавиани и Агости (Merck, Германия) и селективный питательный агар для листерий ПАЛ (ФБУН ГНЦ ПМБ, Россия) и инкубированы при температуре (37 ± 1) °C в течение 24–48 часов. На хромогенном агаре для листерий рост L. monocytogenes в виде
синих колоний с зоной помутнения среды вокруг, на ПАЛ — коричневые колонии с черными ореолами. Колонии типичные
для рода Listeria и L. monocytogenes пере севали на трипказо-соевый агар с дрож жевым экстрактом (TSAYE), и инкубиро вали при (37 ± 1) °C в течение 18–24 часов.
Идентификацию проводили с использованием биохимических тестов (Оxoid).
Выделение и подтверждение бактерий рода Salmonella
Исследование образцов на наличие бактерий рода Salmonella проводили согласно ГОСТ 31659. Для предварительного
обогащения 25 г навески мяса гомогенизировали в 225 см3 забуференной пептонной воды (ЗПВ) и инкубировали при
температуре (37 ± 1) °C. Через 16–18 часов отбирали по 1 см3 обогащённого материала в RVS и MKTT бульоны (Merck, Гер-
мания) и инкубировали при (41,5 ± 1) °C и (37 ± 1) °C соответственно не менее 24 часов. По истечении этого времени пересевали на чашки с XLD агаром (Merck, Германия), Brillians Salmonella агаром (Oxoid,
Великобритания), которые инкубировали при (37 ± 1) °C в течение 24 часов. Типичные и антипичные колонии подтверждали с помощью серологических и биохимических тестов (Оxoid, Великобритания).
Изучение профиля устойчивости, выделенных микроорганизмов
Для получения суточной культуры микроорганизмы выращивали при (37 ± 1) °C в течение 24 часов. Из суточной культуры готовили суспензию мутностью равно 0,5 по стандарту Мак-Фарланда, что соот-
ветствует концентрации 1,5*108 КОЕ/см3.
Суспензию клеток в объёме 100 мк наносили на агар Мюллера-Хинтон и распределяли по всей поверхности шпателем. Сверху распределяли диски с различными концентрациями следующих
антибиотиков: Амоксициллин 20 мкг, Ципрофлоксацин 5 мкг, Гентамицин 10 мкг, Тетрациклин 30 мкг, Эритромицин 15 мкг
(DMM063-ThermoFisher Scientific, Южная Африка). Чашки инкубировали при температуре (37 ± 1) °C в течение 24 часов, после
чего измеряли зону ингибирования роста. Диаметры зон ингибирования были замерены с точностью до миллиметра.
Микроорганизмы были классифицированы как восприимчивые, промежуточные и устойчивые в соответствии с CLSI, 2015.
Восприимчивые и промежуточные были объединены в одну группу — восприимчивые микроорганизмы к антибиотикам.
Результаты исследования
Был проведён мониторинг мяса разных видов животных, в том числе птицы на наличие антимикробных химиотерапевтических веществ. Результаты представлены на рисунках 1, 2, 3.
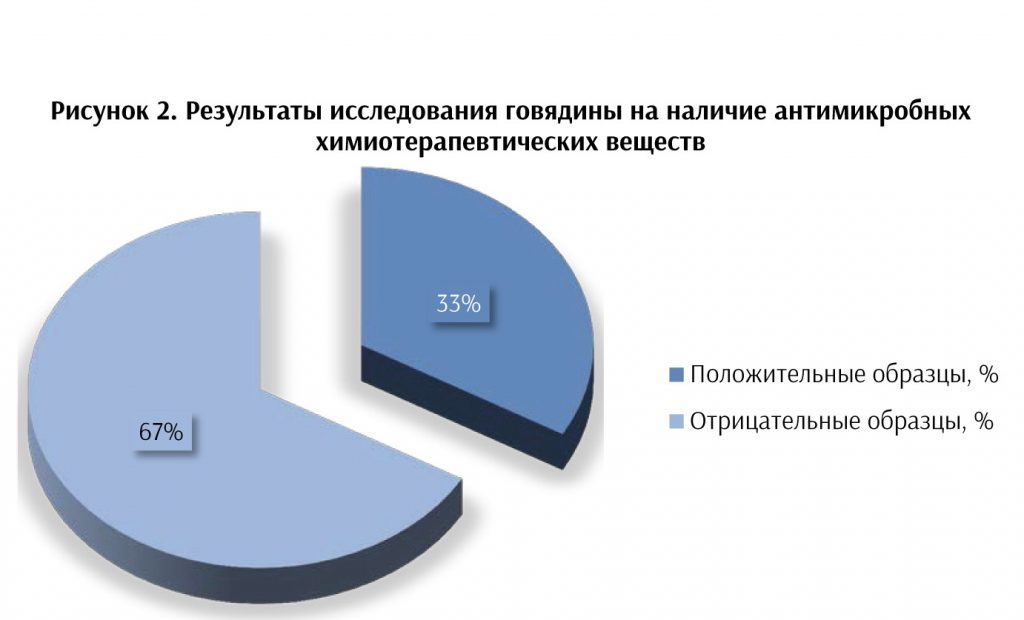
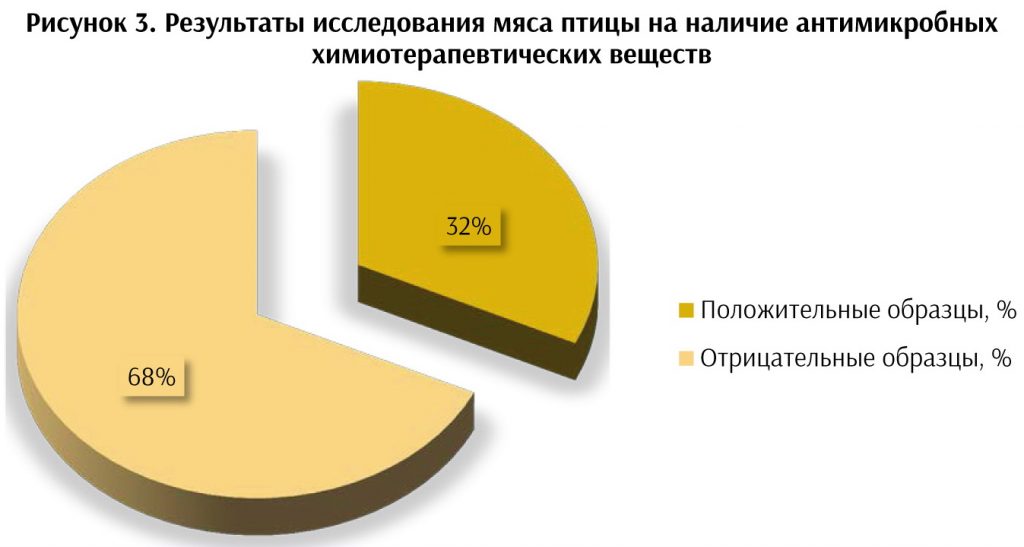
Полученные в ходе исследования и представленные на рисунках 1, 2, 3 данные свидетельствуют о высоком уровне контаминации говядины (33 %), свинины (26 %) и мяса птицы (32 %) антимикробными химиотерапевтическими веществами. Проблема бесконтрольного использования антибиотиков в животноводстве
по-прежнему остаётся актуальной.
Такая ситуация не могла не сказаться на микрофлоре мяса. Для изучения возможного воздействия этих веществ на сальмонеллы и L. monocytogenes мясо, в котором обнаружили антимикробные
химиотерапевтические вещества, было исследовано на наличие этих патогенных микроорганизмов. Результаты исследования представлены на рисунке 4. Данные, представленные на рисунке 4,
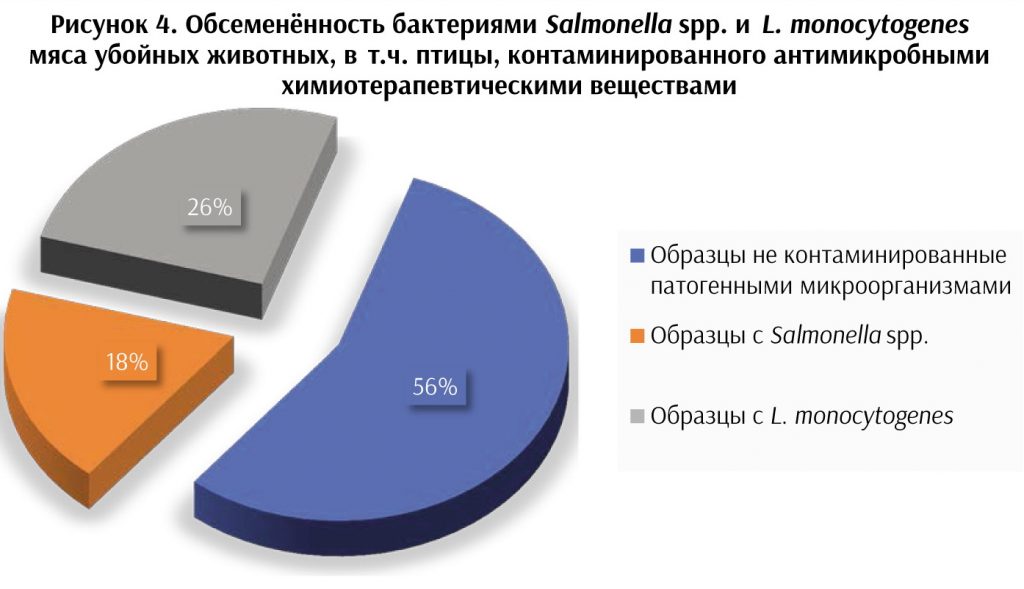
показывают, что больше половины исследованного мяса не обсеменено искомыми патогенами. Однако L. monocytogenes
встречаются в 23 %, а Salmonella spp. в 16 % исследованных образцов.
Оценка профиля устойчивости 9-ти выделенных штаммов микроорганизмов представлена в таблице 1.
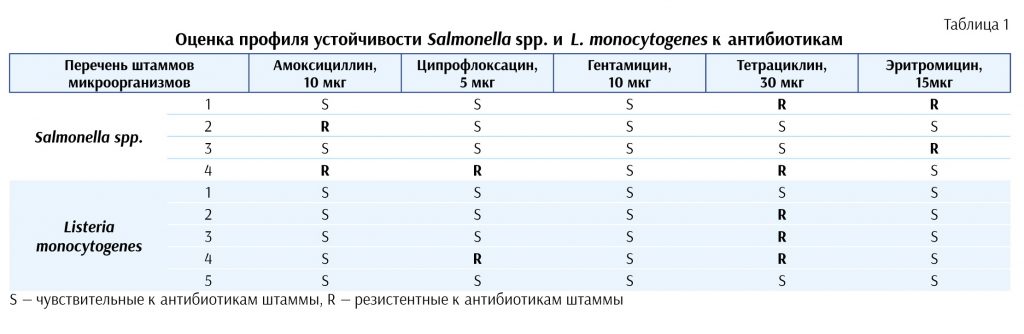
Выявлена устойчивость отдельных штаммов Salmonella spp. к амоксициллину (2 штаммов), ципрофлоксацину (1 штамма), тетрациклину (2 штаммов) и эритромицину (2 штаммов). При этом один из штаммов устойчив сразу к действию 3-х антибиотиков. Бактерии L. monocytogenes проявляли устойчивость к воздействию
тетрациклина (3 штамма) и ципрофлоксацина (1 штамм). Как среди сальмонелл (1 штамм), так и L. monocytogenes (1 штамм) были выявлены штаммы с множественной устойчивостью к антибиотикам.
Обсуждение
По результатам собственных исследований установлено, что наибольшую устойчивость сальмонеллы, выделенные из мяса,
проявляют к действию амоксициллина, эритромицина и тетрациклина, при этом к гентамицину устойчивость установлена
не была. Данные по выявленным из мяса, произведённого в Южной Африке, устойчивых к антибиотикам сальмонелл, коррелировали с данными, полученными нами.
Было установлено, что устойчивость сальмонелл к ампициллину достигала 100 %, стрептомицину 70 %, сульфаметоксазолу
58 %, а к тетрациклину доходила до 50 % [14].
Бактерии L. monocytogenes, в рамках этой работы, проявили наибольшую устойчивость к антибиотикам тетрациклиновой группы и циплофлоксацину, но оказались чувствительны к действию
амоксициллина, гентамицина и эритромицина. В исследованиях других учёных, также была установлена резистентность
к ципрофлоксацину и тетрациклину, L. monocytogenes, выделенных из различных пищевых продуктов [15, 16].
Результаты собственные и других исследователей являются доказательством чрезмерного использования антибиотиков в животноводстве. Данное обстоятельство будет способствовать передаче, резистентных к антибиотикам «пищевых патогенов через пищевую цепь человеку.
Полученные результаты подчёркивают необходимость надежных национальных программ по недопущению возникновения и распространения, устойчивых к антибиотикам патогенных микроорганизмов через пищевые продукты, поскольку
это может быть положительным вкладом в инициативу «единого здоровья».
Источник: Журнал «Все о мясе», 2019, №3, стр 50



